

Doelen
- Je kunt de massa van een molecuul berekenen.
- Je kunt de massa bij een chemische formule berekenen.
- Je kunt met een verhoudingstabel werken.
Rekenen aan moleculen
Je kunt de massa van atomen en ionen berekenen. Omdat moleculen uit atomen bestaan kun je nu ook de massa van moleculen berekenen. Chemische reacties bestaan weer uit moleculen dus ook bij chemische reacties kun je de massa berekenen.
Wet van behoud van massa
Bij een chemische reactie blijft de massa van de stoffen behouden. Er komt tijdens de reactie geen massa bij en er gaat geen massa weg. De beginstoffen hebben samen dezelfde massa als de reactieproducten.
Het lijkt er soms op dat stoffen zwaarder of lichter worden als ze reageren. Als je bijvoorbeeld een schaaltje benzine verbrand is er na afloop niets meer van over. De benzine lijkt verdwenen en de massa lijkt nul te zijn. Als je de reactieformule bekijkt snap je waarom.
2 C8H18 (l) + 25 O2 (g) -> 16 CO2 (g) + 18 H2O (g)
Bij de verbranding van de vloeibare benzine is het gas zuurstof nodig. Na de reactie zijn er alleen maar gassen over. De gassen zijn onzichtbaar en vervliegen uit het schaaltje. Het lijkt dus alsof de stoffen bij de verbranding verdwijnen maar dat is niet zo.
Massa van atomen
Atomen hebben een bepaalde massa. Deze kun je vinden in het periodieksysteem. In de paragraaf over atomen heb je geleerd hoe je uit het periodieksysteem de massa van een atoom kunt opzoeken.
Massa van moleculen
De massa van een molecuul is de massa van de atomen die er inzitten samen. In sommige moleculen komt een atoom meerdere malen voor en dan moet die massa ook meerdere keren meegeteld worden.
In NaCO3 zitten 5 atomen. Natrium heeft een massa van 23u, koolstof: 12u en 3x zuurstof, 3x16 = 48u. Samen is dat 23 + 12 + 48 = 83u. NaCO3 heeft dus een massa van 83u.
Massa in een reactie
In een reactie komen moleculen soms meerdere keren voor. De verhouding van de massa van de moleculen in de reactie geeft ook de verhouding van de massa in het echt weer.
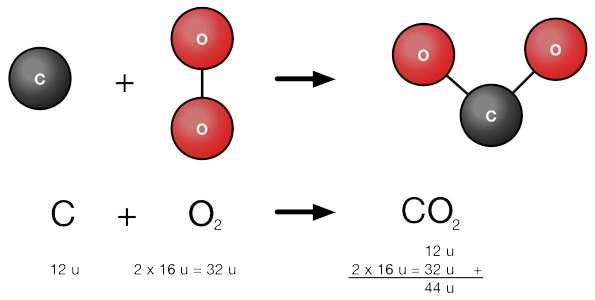
Bij het ontstaan van CO2 uit koolstof en zuurstof hoort de volgende reactievergelijking:
C + O2 -> CO2
De massaverhouding van koolstof en zuurstof is 12u staat tot 32u. Koolstof heeft een massa van 12 en 2 zuurstof atomen hebben ieder een massa van 16u en samen dus 32u.
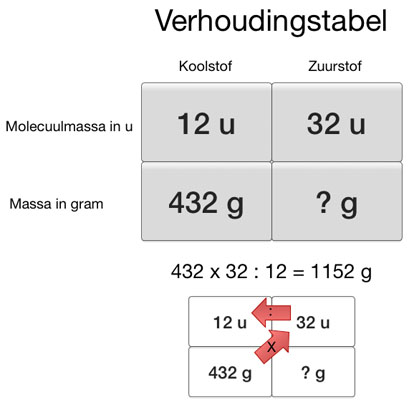
Verhoudingstabel
Met behulp van een verhoudingstabel kun je uitrekenen hoe de massaverhouding in u en in gram overeenkomen. Eerst bereken je de verhouding van de massa van de moleculen in een reactie. Daarna bereken je de verhouding van de massa in mg, g of kg.
Voor een verhoudingstabel geldt: Schuin vermenigvuldigen, recht delen.
Voor de reactie is 200g stof aanwezig. Hoeveel gram is er na de reactie aanwezig?
Voor de reactie is 124 u stof aanwezig. Hoeveel u is er na de reactie aanwezig?
Als 48g zuurstof reageert met 112g ijzer, hoeveel ijzeroxide ontstaat er dan?
Gaat er tijdens een chemische reactie massa verloren?
Komt er tijdens een chemische reactie massa vrij?
Na de verbranding van een stuk hout van 300g wordt de massa van de resten gemeten. Die massa is 120g. Is er tijdens de chemische reactie massa verloren gegaan? Leg uit.
Wat is de massa van een magnesium atoom?
Wat is de massa van een zuurstof atoom?
Wat is de massa van CO2?
Wat is de massa van NH3?
Wat is de massa van O2?
Wat is de massa van C2H6O?
Wat is de massa van NaCl?
Wat is de massa van CO3H3?
Wat is de massa van Co3H3?
Bereken in deze reactievergelijkingen de massa's van de moleculen:
CH4 + 2 O2 -> CO2 + 2 H2O
4 Fe + 3 O2 -> 2 Fe2O3
Na + Cl -> NaCl
HCl + BaOH -> H2O + BaCl
CuSO4 + ZnS -> CuS + ZnSO4
C6H12O6 + 6O2 -> 6CO2 + 6H2O
Maak onderstaande reactievergelijkingen kloppend en geef de massa van de moleculen
N + H -> NH3
C4H10 + O2 -> CO2 + H2O
30g methaan verbrand volgens de reactieformule:
CH4 + 2O2 -> CO2 + 2H2O.
Hoeveel gram zuurstof is er nodig?
Natrium reageert met Chloor naar natriumchloride. Er ontstaat 400g NaCl. Hoeveel natrium en hoeveel chloor is er nodig voor deze reactie?
Verandert de totale massa in het universum? Leg uit en tweet je antwoord met #dal_nask.


