

Doelen
- Je kent de molecuultheorie
- Je kunt met de molecuultheorie de fases verklaren
- Je kent de bouwstenen van moleculen
Molecuultheorie
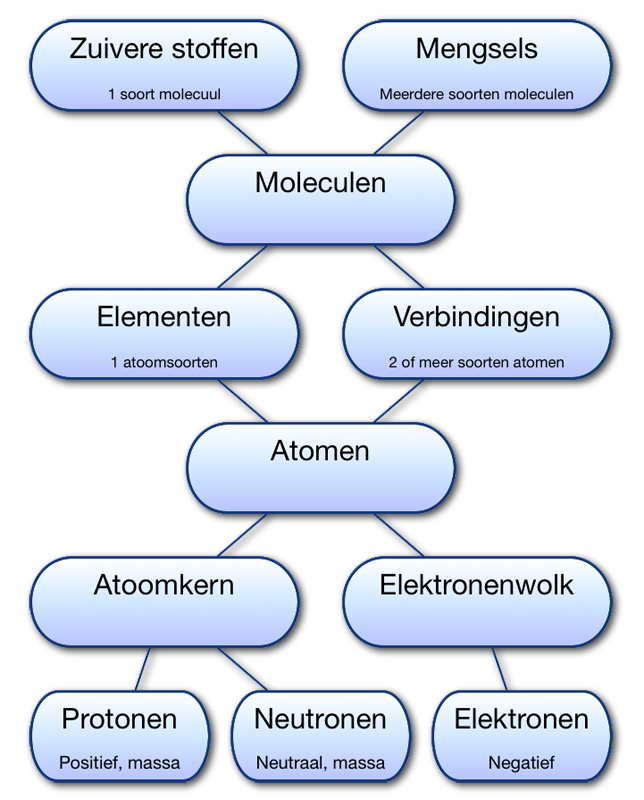
Onze wereld bestaat uit moleculen. Sterker nog, alles bestaat uit moleculen. Moleculen zijn de kleinste deeltjes die nog de eigenschap van de stof bezitten. Als je een stukje papier doormidden scheurt heb je 2 kleinere stukken. Als je 1 van die kleine stukken nog een keer doorscheurt heb je weer 2 kleinere stukken. Dit kun je herhalen tot je de laatste 2 moleculen van elkaar los scheurt. Als je daarna door gaat moet je het papier molecuul doorscheuren en houdt je dus geen papier meer over.
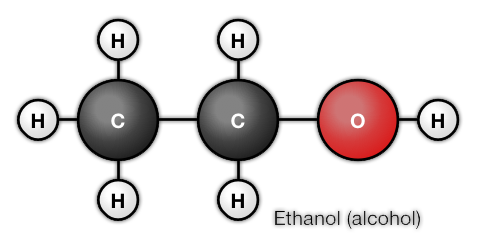
De moleculen zijn zo klein dat je ze niet kunt zien. Zelfs met een microscoop zijn ze nog steeds onzichtbaar. 1 Molecuul heeft een grootte van 0,0000001 mm. Dat betekent dat als je op 1cm van je geodriehoek een aantal moleculen naast elkaar legt, je 100.000.000 moleculen nodig hebt. Er zijn echter speciale elektronen microscopen die moleculen kunnen waarnemen. Hiernaast zie je een foto van een alcohol molecuul.
In het kort is de molecuultheorie:
- Elke stof bestaat uit moleculen
- Elke stof heeft zijn eigen unieke soort moleculen
- Alle moleculen van een zuivere stof zijn identiek
Er bestaan in totaal ongeveer 4.000.000 soorten moleculen. Er worden iedere dag nog nieuwe moleculen uitgevonden.
Omdat we nu kennis gaan nemen van moleculen bespreken we kort een paar oude onderwerpen in het licht van de molecuultheorie.
Fases
De fase van een stoft hang af van de temperatuur. Dat heb je eerder al geleerd. Ook wist je al dat de moleculen bij hogere temperaturen sneller trillen. De fases van een stof worden bepaald door de staat van de moleculen.
Vast
In een vaste stof trillen de moleculen op hun plaats. Hoe warmer het is, hoe sneller ze trillen. Bij het absolute nul punt (-273 C of 0 K) staan de moleculen stil.
Vloeistof
In een vloeistof bewegen de moleculen langs elkaar heen. Ze zitten iets verder uit elkaar dan bij een vaste stof maar ze botsen voortdurend tegen elkaar aan.
Gas
In een gas zweven de moleculen vrij rond. Omdat ze zo klein en licht zijn hebben ze bijna geen last van de zwaartekracht. Ze botsen soms tegen elkaar aan. De afstand tussen de moleculen is erg groot.
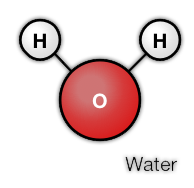
Er zijn uitzonderingen op de theorie van de fases. Water bestaat uit geladen moleculen met een kleine positieve en negatieve kant. Hierdoor ontstaat in de vaste fase een raster met wat meer ruimte tussen de moleculen dan in de vloeibare fase.
Chemische reacties
Bij fase veranderingen, mengen en scheiden van mengsels veranderen de moleculen niet. Ook de stofeigenschappen van de stoffen veranderen niet. Wat wel verandert is hoe de stof eruit ziet. Omdat de moleculen zelf niet veranderen maar de samenstelling van de moleculen wel, noemen we deze processen geen chemische reacties. Pas als de moleculen zelf veranderen spreken we van een chemische reactie.
Dichtheid
De dichtheid is de hoeveelheid massa per stukje volume. Gram per cm3. Als de moleculen dicht op elkaar staan bij een vaste stof of vloeistof, hebben we veel massa op een klein stukje ruimte. Dit is een hoge dichtheid. Als de moleculen ver van elkaar af staan zoals bij een gas, hebben we weinig massa op een stukje ruimte en dus een lage dichtheid.
Je kunt dus met de molecuultheorie van fases verklaren waarom de dichtheid van een gas veel lager is dan die van een vaste stof. De moleculen staan verder uit elkaar.
Atomen
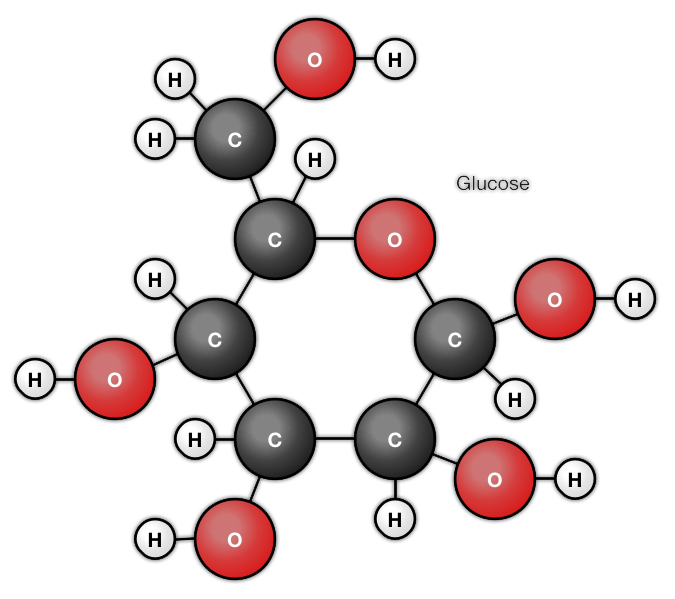
Moleculen zijn niet de kleinste deeltjes die we kennen. Moleculen bestaan uit atomen. Atomen zijn de bouwstenen van de moleculen. Er zijn moleculen die wel uit honderden atomen bestaan. Gelukkig zijn de meeste moleculen eenvoudiger. Van de atomen kennen we er slechts 118 maar er worden af en toe nog nieuwe ontdekt.
We hebben de atomen genummerd en ieder atoom heeft een naam en een afkorting. In de klas hangt het periodiek systeem. Hier staan alle atomen op.
Je kunt door atomen te combineren verschillende moleculen maken. Als je met 118 atomen moleculen kunt bouwen en ze mogen meer dan 100 atomen groot zijn kun je heel veel combinaties maken. Vandaar dat er ook ongeveer 4.000.000 moleculen zijn. Toch zijn er natuurwetten die ervoor zorgen dat niet alle combinaties van atomen mogelijk zijn. Je gaat deze natuurwetten de komende jaren leren.
1
Bentwoord de vraag die in dit filmpje wordt gesteld.
2
Pak een A4-tje. Bekijk dit filmpje en maak met behulp van de app iMotion HD en iMovie een beter filmpje. Wees creatief. Plaats je film op Youtube enTwitter de link met #dalton_molecuul
3
Bereken hoeveel moleculen ongeveer in een zoutkorrel van 1 mm3 zitten.
4
Leg met behulp van de molecuultheorie uit wat het verschil is tussen een zuivere stof en een mengsel.
5
Hoe bewegen de moleculen van een vloeistof.
6
Wat gebeurt er met de afstand en de snelheid van moleculen als een gas vloeibaar wordt?
7
Wat gebeurt er met de moleculen van een stof als de stof smelt? En als deze verdampt.
8
Uit welke moleculen bestaat: Water? En Alcohol? En suikerwater?
9
Geef bij onderstaande situaties aan of de moleculen veranderen en of er sprake is van een chemische reactie:
-Het verbranden van magnesium
-Het smelten van ijs
-Het reageren van ijzer en zoutzuur
-Het filtreren van regenwater
-Het indampen van zout water
-Het oxideren van aluminium
10
Waarom is de dichtheid van gesmolten kaarsvet kleiner dan die van vast kaarsvet?
11
In welke fase is de dichtheid van een stof het kleinst? Leg ook uit waarom?
12
Welke stoffen zitten er in de lucht?
13
Maak een cirkeldiagram van de samenstelling van lucht.
14
Bij verschillende fases is de afstand tussen de moleculen soms groter en soms kleiner. Wat zit er tussen de moleculen van een stof?
15
Bekijk deze video. Waarom kun je een met water gevulde kluis openen door deze op te blazen en een kluis gevuld met lucht niet?
16
Maak een foto van het periodieksysteem dat in de klas hangt.
17
Wat betekenen de kleuren in het periodieksysteem?
18
Geef aan waarom deze zin niet klopt: Atomen bestaan uit moleculen.
19
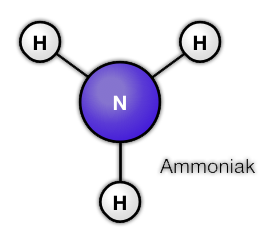
Uit welke atomen bestaat een ammoniak molecuul? En Water, glucose en Ethanol?
20
Hoeveel moleculen zijn er ongeveer?
21
Hoeveel atomen zijn er ongeveer?
22
Uit hoeveel atomen kan een molecuul bestaan?
23
Maak deze woordzoeker af.


