


Doelen
- Je kunt een ontledingsreactie herkennen
- Je kent de drie type ontledingsreacties
Ontleden
Een ontledingsreactie kun je herkennen aan het feit dat er 1 beginstof is en meerdere reactieproducten. De moleculen van de beginstof gaan stuk en er ontstaan uit de begin moleculen nieuwe moleculen. Hiervoor is meestal energie nodig. Deze energie kan op verschillende manieren toegevoegd worden. Warmte, elektriciteit of straling in de vorm van licht.
Thermolyse
Thermolyse in een ontledingsreactie als gevolg van warmte. Het is een reactie die misschien lijkt op een verbranding maar bij thermolyse is geen zuurstof nodig. Er is maar 1 beginstof en bij een verbranding zijn 2 beginstoffen. Brandstof en zuurstof.
Bij de ontleding van organische stoffen ontstaan vaak de reactieproducten CO2 en H2O. Bij het ontleden van hout, papier en suiker ontstaan ook gassen die brandbaar zijn. Tijdens een ontleding kunnen die gassen door de warmte ook gaan branden. Hiervoor is dan wel zuurstof nodig.
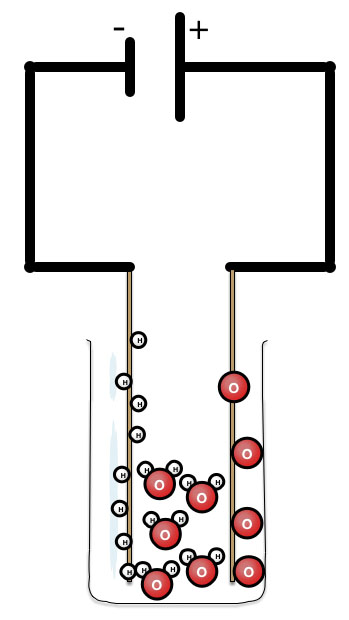
Elektrolyse
Door elektrische energie kunnen sommige stoffen ontleden. Bijvoorbeeld zouten, zuren en basen kunnen ontleden. Maar ook water kan ontleden door elektrische stroom. Omdat water uit geladen deeltjes bestaat namelijk H+ en O2- kan de elektrische stroom ervoor zorgen dat de positieve H+ deeltjes naar de negatieve elektrode gaan en de negatieve O2- deeltjes naar de positieve elektrode.
Fotolyse
Door de aanwezigheid van licht kunnen sommige stoffen ontleden. Dit is goed te zien in fotopapier. Zolang dit papier zich in een donkere ruimte bevindt blijft het wit. Als het in aanraking komt met licht wordt het zwart.
Reactieschema
Reacties kun je weergeven in een reactieschema. Dit geldt ook voor ontledingen. Een reactieschema kan er zo uitzien:
- Hexaan (l) + Zuurstof (g) -> Water (l) + Koolstofdioxide (g)
Bij iedere stof geef je aan in welke fase de stof is. De stoffen voor de pijl noemen we beginstoffen. De stoffen na de pijl zijn reactieproducten. Ontledingsreacties kun je herkennen aan het feit dat is maar 1 beginstof is.
- Water (l) -> Waterstof (g) + Zuurstof (g)
24
Wat is een ontledingsreactie?
25
Is elke ontledingsreactie een chemische reactie?
26
Wat gebeurt er met de moleculen van een stof tijdens een ontledingsreactie?
27
Geef aan of onderstaande reacties chemische reacties zijn en of het ontledingsreacties zijn.
IJs (s) -> Water (l)
IJzeroxide (s) -> IJzer (s) + Zuurstof (g)
Waterstofperoxide (l) -> Water (l) + zuurstof (g)
Magnesium (s) + Zuurstof (g) -> Magnesiumoxide (s)
Kaarsvet (s) -> Kaarsvet (l)
Natriumchloride (s) -> Natrium (s) + Chloor (g)
Ammoniumdichromaat (s) -> chroomoxide (s) + stikstof (g) + water (g)
28
Wat zijn de 3 typen ontledingsreacties?
29
Waarom is er licht, warmte of elektriciteit nodig voor sommige ontledingsreacties?
30
Geef het reactieschema van de elektrolyse van aluminiumoxide. Let op de fase aanduiding (s), (l), (g).
31
Bij de fotolyse van zilverchloride ontstaan zilver en chloor. Maak een reactieschema van de ontleding. Let op de fase aanduiding (s), (l), (g).
32
Uit welke atomen bestaat water?
33
Welke stoffen ontstaan er bij de elektrolyse van water?
34
Welke stof ontstaat er bij de positieve elektrode bij de elektrolyse van water?
35
Geef het reactieschema van de ontleding van water door elektrolyse.
36
Welke stoffen ontstaan bij de ontleding van een organische stof?
37
Waarom is thermolyse niet hetzelfde als verbranden? Wat is het verschil?


