
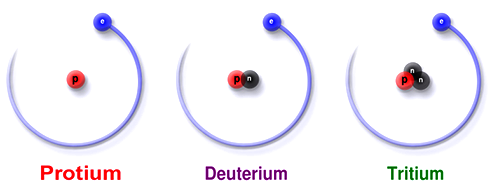



Wat is een isotoop?
Wat is het verschil tussen een instabiel en een stabiel isotoop?
In welke tabel van Binas vind je de isotopen?
Welke isotopen van aluminium zijn er?
Waaraan kun je in de Binas zien of een isotoop stabiel is?
Wat is de naam van het isotoop met 11 protonen en 11 neutronen?
Is het isotoop met 11 protonen en 11 neutronen stabiel?
Is het isotoop met 11 protonen en 12 neutronen stabiel?
Is er een formule of berekening om aan de hand van het aantal protonen en neutronen te bepalen of een isotoop stabiel is?
Welke isotopen van uranium zijn er?
Zijn deze isotopen stabiel of instabiel?
Van plutonium zijn 2 isotopen. Pu–239 en Pu–241. Beide zijn instabiel. Welke zal meer straling geven? Waarom?
Bij welk isotoop (Pu–239 of Pu–241) zal het langer duren tot deze geen straling meer geeft?
Welk uranium isotoop is het beste geschikt voor een kerncentrale?
Is er een stabiel uranium isotoop?
Is er een instabiel chloor isotoop?
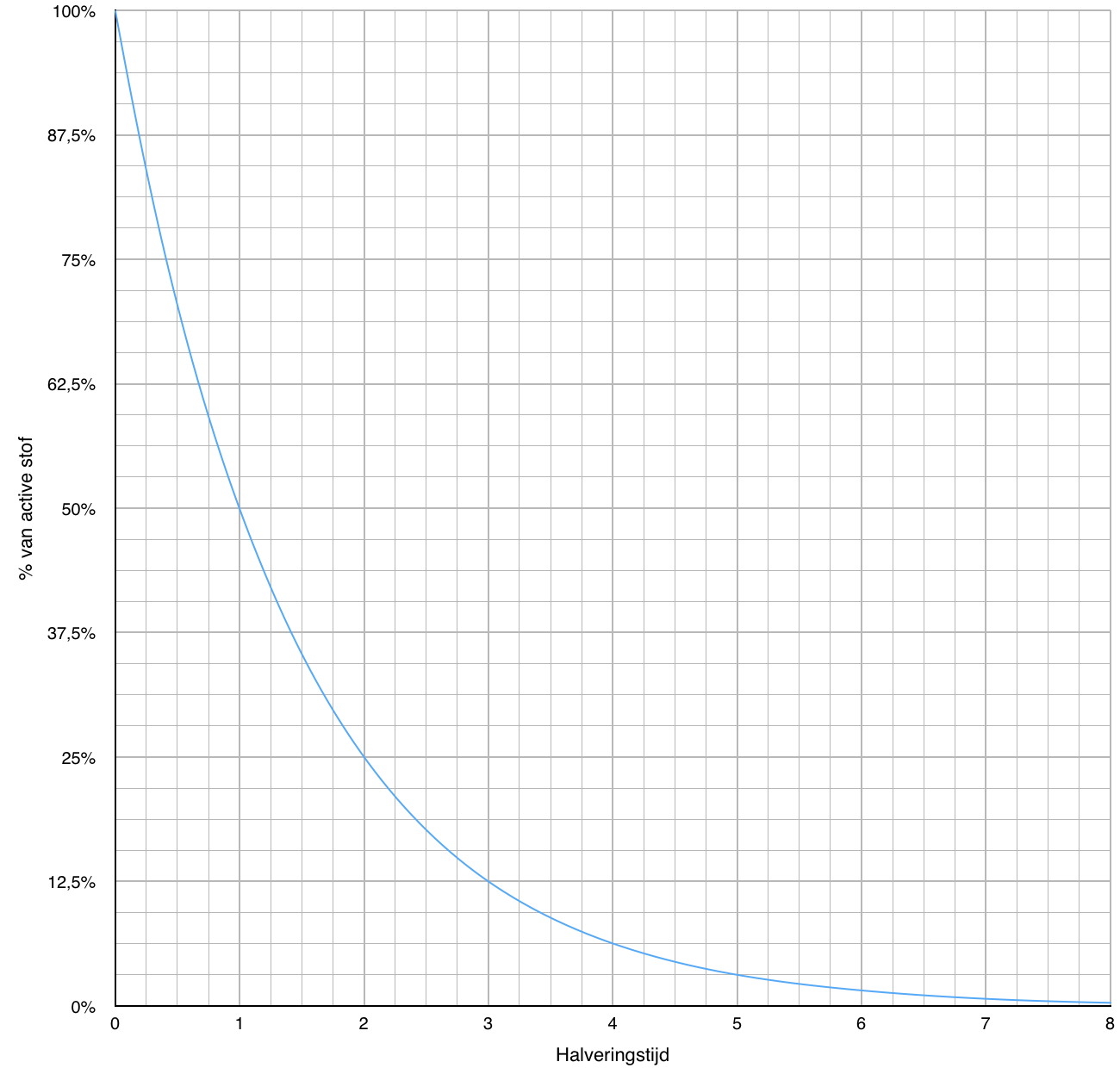
Wat is halveringstijd?
Hoe lang duurt het voor de helft van de Fe–59 atomen in een blokje van 160 g vervallen is?
Welke straling komt van het blokje Fe–59?
Hoeveel protonen heeft een Fe–59 atoom?
Hoeveel protonen heeft de stof die overblijft als een Fe–59 atoom vervallen is?
Welke stof zal ontstaan als een Fe–59 atoom vervalt?
Hoeveel gram van het blokje van 160 g Fe–59 is vervallen na 45 dagen?
Hoeveel keer past de halveringstijd van Fe–59 in een periode van 360 dagen?
Hoeveel gram Fe–59 is er nog over na 360 dagen?
Hoeveel gram van de andere stof is er aanwezig na de 360 dagen?
Van een bepaalde radioactieve stof wordt de intensiteit van de straling gemeten op 4.000.000 Bq. De straling neemt snel af en na 48 seconde is het niveau gedaald tot 1.000.000 Bq. Welke stof is de radioactieve stof?
Hoe hoog zal de straling zijn na nog eens 48 seconden?
Hoeveel keer moet de straling halveren tot deze een niveau bereikt onder 7.000 Bq?
Hoe lang duurt het tot de straling gedaald is onder het acceptabele niveau van 7.000 Bq?
Een kernramp met plutonium is erg vervelend. Er worden 2 stellingen gedaan over plutonium. 1: Pu–239 is erger omdat deze een lage halveringstijd heeft. 2: Pu–241 is erger omdat deze een kortere halveringstijd heeft. Bedenk welke stelling klopt en overleg jouw uitleg met een een klasgenoot.
Waarom komen instabiele isotopen in de natuur weinig voor?
In een blok koper van 6 kg zit Cu–63 en Cu–64. Welke van deze isotopen is instabiel?
Er wordt gemeten dat van de 6 kg koper 0,7% Cu–64 is. Bereken hoeveel gram Cu–64 er in het blok zit.
2 Dagen later doet een ander laboratorium onderzoek naar hetzelfde koperen blok. Zullen zij ook 0,7% Cu–64 meten?
Bereken het percentage Cu–64 in het blok dat het tweede lab zal meten.
Bereken hoeveel gram Cu–64 het tweede lab zal meten.
Bij het tweede laboratorium wordt nog een andere stof in het koper gemeten. Welke stof verwacht je dat is ontstaan door het verval van Cu–64?
In een zwaard uit de middeleeuwen zit veel ijzer. Verwacht je in het ijzer meer Fe–56 of meer Fe–59? Leg uit waarom.
Je wilt een in een experiment vaststellen hoe oud een zwaard is. Je meet dat in het ijzeren zwaard nog 0,4 mg Fe–59 zit. In een zwaard dat uit een moderne fabriek komt zit 25,6 mg Fe–59. Bereken hoe lang geleden het zwaard uit de fabriek kwam.
De straling van een radioactive stof is op een bepaald moment 800 Bq. Na 1 dag is de straling 384 Bq. Welke stof is de radioactive stof?
Na hoeveel tijd na de eerste meting van 800 Bq zal er nog 25 Bq straling van de stof komen?
Maak een diagram van de straling van de stof. Zet op de horizontale as de tijd van 0 tot 7 dagen en op de vertikale as de straling van 0 tot 800 Bq.
Maak een ander diagram van het verval van 1000 gram Pu–241. Zet op de horizontale as de tijd van 0 tot 100 jaar en op de vertikale as de hoeveelheid Pu–241 van 0 tot 1000 gram.
Vergelijk de diagrammen van de vorige 2 vragen. Wat valt je op?
Doelen
- Je kunt opzoeken of een kern stabiel of instabiel is.
- Je kunt de halveringstijf opzoeken.
- Je kunt rekenen met de halveringstijd.
Isotopen
Alle stoffen bestaan uit moleculen en de moleculen bestaan weer uit atomen. Er zijn van sommige atomen meerdere versies. Deze versies noemen we isotopen. Je kunt de isotopen vinden in Binas tabel 32. Je ziet bijvoorbeeld dat er van waterstof (H) 3 versies zijn. Er is gewoon waterstof (H), er is deuterium (H2) en er is tritium (H3).
Stabiele en instabiele isotopen
Er heerst een misverstand dat atomen stabiel zijn als er evenveel protonen als neutronen in de kern zitten. Dit is niet waar. De stof koper heeft bijvoorbeeld 29 protonen en 34 neutronen. Toch is dit een stabiele stof. Het koper isotoop Cu–64 heeft 29 protonen en 35 neutronen en is instabiel.
Je kunt niet berekenen of met een truukje bepalen of een kern stabiel of instabiel is. Dit zul je altijd moeten opzoeken in de Binas tabel 32.
| Protonen | Neutronen | Massa | Halveringstijd | Straling | |
|---|---|---|---|---|---|
| Cu-52 | 29 | 23 | 52 | onbekend |
α |
| Cu-53 | 29 | 24 | 53 | < 300 ns | α |
| Cu-54 | 29 | 25 | 54 | < 75 ns | α |
| Cu-55 | 29 | 26 | 55 | 200 ns | β |
| Cu-56 | 29 | 27 | 56 | 93 ms | β |
| Cu-57 | 29 | 28 | 57 | 196,3 ms | β |
| Cu-58 | 29 | 29 | 58 | 53,4 min | β |
| Cu-59 | 29 | 30 | 59 | 81,5 s | β |
| Cu-60 | 29 | 31 | 60 | 23,7 min | β |
| Cu-61 | 29 | 32 | 61 | 3,333 uur | β |
| Cu-62 | 29 | 33 | 62 | 9,673 min | β |
| Cu-63 | 29 | 34 | 63 | ||
| Cu-64 | 29 | 35 | 64 | 12,7 uur | β |
| Cu-65 | 29 | 36 | 65 | ||
| Cu-66 | 29 | 37 | 66 | 5,120 min | β |
| Cu-67 | 29 | 38 | 67 | 61,83 h | β |
| Cu-68 | 29 | 39 | 68 | 31,1 s | β |
| Cu-69 | 29 | 40 | 69 | 2,85 min | β |
| Cu-70 | 29 | 41 | 70 | 44,5 s | β |
| Cu-71 | 29 | 42 | 71 | 19,4 s | β |
| Cu-72 | 29 | 43 | 72 | 6,6 s | β |
| Cu-73 | 29 | 44 | 73 | 4,2 s | β |
| Cu-74 | 29 | 45 | 74 | 1,594 s | β |
| Cu-75 | 29 | 46 | 75 | 1,224 s | β |
| Cu-76 | 29 | 47 | 76 | 641 ms | β |
| Cu-77 | 29 | 48 | 77 | 469 ms | β |
| Cu-78 | 29 | 49 | 78 | 342 ms | β |
| Cu-79 | 29 | 50 | 79 | 188 ms | β |
| Cu-80 | 29 | 51 | 80 | 300 ns | β |
Halveringstijd
Halveringstijd is de tijd waarin de helft van de instabiele kernen is vervallen. Vervallen betekent dat de kern uiteen is gevallen en daarbij straling heeft afgegeven. Het vervallen van een kern is niet te voorspellen. Er is slechts te bepalen hoe groot de kans is dat een kern vervalt. De tijd waarin de kans 50% is dat een kern vervalt noemen we de halveringstijd. Omdat er heel veel atomen in een stof zitten kun je met grote zekerheid zeggen dat na de halveringstijd de helft van de atomen is vervallen.
Omdat de hoeveelheid instabiele atomen afneemt, neemt ook de activiteit af. Een instabiele stof zendt in het begin erg veel straling uit, er vervallen dan veel atomen. Na verloop van tijd neemt de straling af. Dit loopt gelijk met de halveringstijd. Hierdoor duurt het erg lang voordat stoffen geen straling meer afgeven.


