



Doelen
- Je kent het atoommodel.
- Je weet welke deeltjes in een atoom zitten.
- Je kunt het aantal deeltjes in een atoom berekenen.
- Je kent de begrippen massagatal en atoomnummer.
1
Wie heeft het experiment geleid waarmee de leegte van het atoom bewezen is?
2
Leg uit hoe het experiment ging.
3
Aan welk deeltje kun je gelijk zien met welk atoom je te maken hebt?
4
Wat is de lading van een elektron?
5
Wat is de massa van een proton?
6
Wat is de massa van een neutron?
7
Welke deeltjes zitten in de kern van een atoom?
8
Wat is de lading van die deeltjes?
9
Wat is de lading van de kern?
10
Waarom blijven elektronen in de buurt van de kern?
11
Waarom kunnen de protonen die elkaar afstoten toch samen in de kern blijven?
12
Als een atoom een massa heeft van 11 u en er zijn 5 protonen aanwezig, hoeveel neutronen zijn er dan?
13
Welk atoom heeft 5 protonen?
14
Welk atoom heeft 23 protonen?
15
Wat is de massa van Helium?
16
Beschrijf welke deeltjes er in een Beryllium atoom zitten.
17
Wat is het lichtste atoom?
18
Wat is het zwaarste bekende atoom volgens de Binas?
19
Welk atoom heeft 12 elektronen?
20
Welke atomen hebben 16 neutronen?
21
Teken schematisch een Boor atoom.
22
Is het massagetal altijd het dubbele van het atoomnummer?
23
Zijn er altijd evenveel neutronen als protonen?
24
Zijn er altijd evenveel elektronen als protonen?
25
Zijn er altijd evenveel neutronen als elektronen?
26
Geef aan hoeveel protonen, neutronen en elektronen in de volgende atomen zitten:
-Jood
-IJzer
-Argon
-Lood
-Kalium
-Magnesium
-Zuurstof
-Xenon.
Atomen
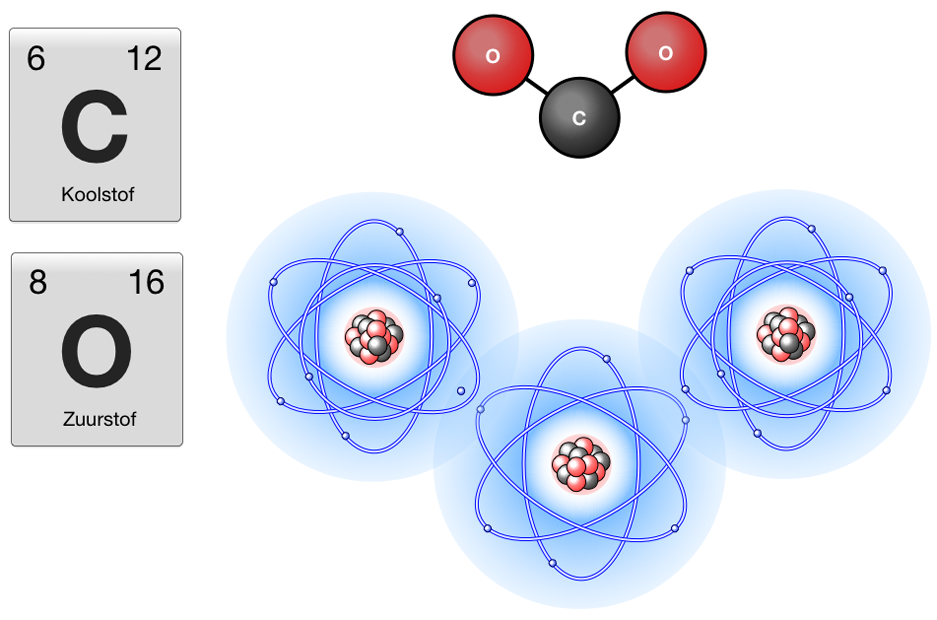
Atomen bestaan uit protonen, neutronen en elektronen. Atomen zijn de bouwstenen van moleculen. Protonen, neutronen en elektronen zijn de bouwstenen van atomen. In dit hoofdstuk gaan we in op de bouw van atomen.
Rutherford Experiment
In 1909 werden er onder leiding van Ernest Rutherford deeltjes op een dun laagje goud gevuurd. De deeltjes gingen meestal door het goud heen en werden soms een andere kant op gestuurd. De conclusie was dat goud (en alle andere atomen) voor het grootste deel leeg zijn. Slechts op een paar plekken zitten deeltjes die voor een botsing zorgen.
Atoommodel
Het atoommodel bestaat uit een kern met protonen en neutronen. Om de kern heen zit een elektronenwolk. De drie fundamentele deeltjes hebben belangrijke eigenschappen. Protonen en neutronen hebben massa, elektronen niet. Elektronen zijn negatief geladen en protonen zijn positief geladen. Neutronen hebben geen lading.
Massa
Protonen en neutronen hebben massa. De 2 deeltjes vormen samen de kern van het atoom. Dit betekent dat alle massa van het atoom in de kern zit. De elektronen die om de kern zweven hebben geen massa. Omdat de deeltjes een heel kleine massa hebben is er een nieuwe eenheid bedacht. Een neutron en een proton hebben een massa van 1,7 x 10-27 kg. Als je het uitschrijft is dat 0,000.000.000.000.000.000.000.000.0016 kg. Daarom is de eenheid u bedacht. Een neutron heeft net als een proton een massa van 1 u.
In het periodiek systeem geeft het massagetal de massa van een atoom aan. Dit massagetal is vaak geen rond getal. Voor je gaat rekenen met aantallen protonen en neutronen moet je het massagetal afronden.
Lading
De elektronen blijven in de buurt van de kern door de elektrische aantrekkingskracht. De negatieve lading van de elektronen vormt een aantrekkingskracht met de positieve protonen in de kern.
Elektronen (e-)
Elektronen vliegen met zeer hoge snelheid rond de kern. Het is niet duidelijk waar de elektronen zich op een bepaald moment precies bevinden maar ze zweven in een wolk om de kern. Er zijn in een atoom altijd evenveel elektronen als protonen zodat de + en - ladingen elkaar opheffen.
Neutronen (n)
De neutronen zijn vulmiddel voor de protonen in de kern. Zonder neutronen zouden de positieve protonen elkaar afstoten. Neutronen spelen een belangrijke rol bij het bepalen van de massa van een atoom.
Protonen (p+)
Het periodiek systeem verdeelt de verschillende soorten elementen. Deze zijn gerangschikt op atoomnummer. Het atoomnummer is het aantal protonen. Het soort atoom wordt dus bepaald door het aantal protonen.
Samenstelling berekenen.
Om het aantal deeltjes in een atoom te berekenen moet je 2 berekeningen doen. Het atoomnummer is het aantal protonen.
Het aantal neutronen moet samen met de protonen de massa vormen. Hieruit volgt dat p+ + n = massagetal. Het aantal protonen moet gelijk zijn aan het aantal elektronen zodat er geen lading over is.
- p = atoomnummer
- n = massagetal - p+
- e- = p+
Grootte en leegte
De afstand van de elektronen tot de kern in verhouding met de kern is 50.000 : 1.
In het experiment van Rutherford werd geconstateerd dat het atoom vooral leeg is en de deeltjes maar weinig ruimte in nemen. De tekeningen op deze pagina geven dus een vertekend beeld van het atoom. Het is moeilijk te bevatten hoeveel leegte er is tussen de kern en de elektronen maar met een voorbeeld kun je misschien een beeld vormen.
Een golfbal heeft een diameter van 4,5 cm. Als de golfbal de kern van een atoom is, dan bevinden de elektronen zich op een afstand van ruim 1 km. Op die afstand kun je de golfbal met het blote oog niet meer zien.


